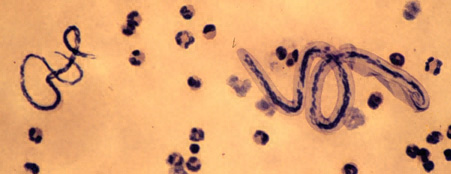
Las Filariasis son infecciones producidas por parásitos nematodos de la familia Filaroidea. Los gusanos adultos son finos y miden entre 1 y 4 cm de longitud. Causan diversos cuadros clínicos, característicos de cada especie individual de filaria. Su transmisión se produce por vectores, ya sean mosquitos u otros artrópodos. Los géneros de filarias de interés sanitario para el ser humano son: género Wuchereria (la especie W.bancrofti), género Brugia (especies B.malayi y B.timori), género Loa (especie Loa loa), y género Onchocerca (especie O.volvulus). Existen algunas otras especies capaces de afectar al ser humano, pero de importancia epidemiológica mucho menor.
FILARIASIS LINFÁTICAS
EPIDEMOLOGÍA
Las Filariasis linfáticas, también denominadas comúnmente “elefantiasis” están producidas por tres especies de filarias: Wuchereria bancrofti, Brugia malayi y en menor medida Brugia timori. El gusano adulto se encuentra en los vasos y ganglios linfáticos de las personas infectadas, donde pueden vivir hasta 6 años. Allí se reproducen y engendran las microfilarias, que llegan a la sangre de 6 a 12 meses tras la infección. Estas microfilarias son ingeridas por el artrópodo vector (mosquitos) y en su interior se transforman en larvas infecciosas al cabo de 1-2 semanas y ya pueden transmitirse a otras personas por la picadura del mosquito.
La Filariasis de Bancroft está producida por W. bancrofti. Los gusanos adultos producen microfilarias que llegan a la sangre con dos perioricidades distintas. En la primera, de periodicidad nocturna, las microfilarias circulan por sangre periférica por la noche, con una concentración máxima entre las 22.00 y las 02.00 horas. En la segunda forma, de subperiodicidad diurna, las microfilarias circulan continuamente por sangre periférica, pero alcanzan su máxima concentración durante el día.
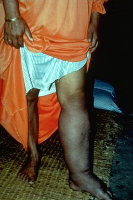
Producen distintas manifestaciones clínicas que incluyen personas asintomáticas expuestas y parasitológicamente negativas,personas con microfilaremia asintomática, personas con fiebre recurrente, linfadenitis y linfangitis retrógrada por filarias, con o sin microfilaremia detectable, personas con síntomas y signos crónicos (hidrocele, quiluria, elefantiasis de miembros, mamas o genitales…) cuya microfilaremia es normalmente muy pequeña o indetectable, y personas que presentan el denominado “síndrome de eosinofilia pulmonar tropical”, caracterizado por asma paroxística nocturna, neumopatía intersticial, fiebre recurrente y eosinofilia, que presentan microfilarias en degeneración detectables en tejidos pero no en la corriente sanguínea.
La Filariasis por Brugia es causada por los nematodos B.malayi o B.timori. Es menos frecuente que la filariasis linfática por W.bancrofti. Cabe destacar que B. timori sólo se encuentra en islas del archipiélago de Indonesia.
La forma periódica nocturna de la filariasis por B.malayi se observa sólo en humanos, pero la subperiódica afecta a humanos y a animales carnívoros salvajes y domésticos.
Las manifestaciones clínicas son semejantes a las de las filariasis de Bancroft, pero los ataques recurrentes de fiebre, adenitis y linfangitis retrógrada son en general más graves, mientras que la quiluria y la elefantiasis suele limitarse a la porción distal de las extremidades inferiores.
El diagnóstico definitivo se realiza por detección de los parásitos, habitualmente más fácil en el caso de las microfilarias que de los parásitos adultos. Pero bastantes infecciones no presentan microfilaremia en sangre (filariasis oculta), lo que obliga al diagnóstico indirecto, por la clínica, eosinofilia y detección de IgE elevada, y la demostración de anticuerpos antifilaria, que deben valorarse cuidadosamente pues presentan reacciones cruzadas con otros nematodos y pueden existir falsos positivos. También puede recurrirse a técnicas confirmatorias más complejas, como detección de ADN por técnicas de PCR, detección de antígenos circulantes y utilización de técnicas de Eco-Doppler, linfografías, etc.
El reservorio es fundamentalmente el ser humano con microfilarias en sangre. Pero por la especie subperiódica de B.malayi existen diversos posibles reservorios animales, como gatos, civetas o primates.
La transmisión se produce por la picadura de mosquitos con larvas infectantes. W.bancrofti es transmitida por muchas especies, entre las que destacan Culex quinquefascialus, Anópheles gambiae, Anópheles funestus y otros. B.malayi es transmitida por diversas especies de Anópheles, Aedes y Mansonia, y B.timori por Anópheles barbirostris. El riesgo para el viajero es muy bajo, con un aumento del mismo en viajero de largo plazo (misioneros, científicos de campo, voluntarios…) ya que la enfermedad por lo general requiere la exposición repetida al vector infectado particular, durante meses o años.
El periodo de incubación en el ser humano es de 3 a 6 meses en el caso de B.malayi y de 6 a 12 meses en infecciones por W.bancrofti, desde la infección hasta que aparecen microfilarias en sangre, pero las manifestaciones inflamatorias alérgicas pueden aparecer en el plazo de un mes después de la infección.
El periodo de transmisibilidad permanece mientras persiste la microfilaremia en sangre del paciente, lo que puede durar hasta 5-10 años tras la infección inicial. El mosquito adquiere infectividad aproximadamente 12 a 14 días después de haber succionado sangre infectada.
La susceptibilidad a la infección es universal, pero existen diferencias geográficas notables en cuanto al tipo y gravedad de la enfermedad. En las zonas endémicas se dan frecuentemente infecciones repetidas.
SITUACIÓN MUNDIAL
Se estima que más de 120 millones de personas en el mundo (73 países endémicos) están infectadas por alguna especie de estas 3 filarias. De ellos, más de 40 millones presentan incapacidades severas y alteraciones morfológicas.
Más del 90% de las infecciones están producidas por W.bancrofti, que es endémica en las regiones cálidas y húmedas del mundo. Se extiende por África subsahariana, el Sudeste asiático, India, Indonesia, varias islas del Pacífico y áreas focales de América Latina (son endémicos aún a día de hoy: Brasil, Guyana, Haití y R.Dominicana). También existen focos activos en Egipto y Yemen. La forma subperiódica es endémica en el Pacífico meridional y en pequeños focos de Asia Sudoriental.
B.malayi afecta principalmente a China, India, Malasia, Filipinas, Indonesia y varias islas del Pacífico. La forma nocturna se transmite en zonas costeras con arrozales y la forma subperiódica se encuentra en los bosques.
B.timori afecta a zonas rurales de la isla de Timor en Indonesia y otras islas de Indonesia.
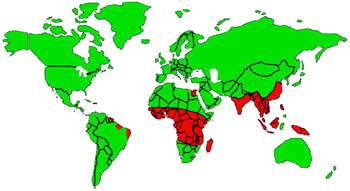
Distribución Filariasis Linfáticas
ONCOCERCOSIS
EPIDEMOLOGÍA
La Oncocercosis o “ceguera de los ríos” está causada por la especie de filaria Onchocerca volvulus. Es una de las causas de ceguera más importante en el mundo y además produce una dermatitis severa.

Las filarias adultas forman nódulos fibrosos en los tejidos subcutáneos, fundamentalmente en la cabeza y los hombros, o en la cintura pelviana y las extremidades inferiores. La filaria hembra expulsa microfilarias que emigran a través de la piel. Estas microfilarias al morir causan una erupción muy pruriginosa, que evoluciona a una dermatitis crónica con alteración de la pigmentación (“piel de leopardo”), edema y atrofia de piel. A menudo las microfilarias llegan a los ojos, donde su invasión y muerte posterior produce alteraciones visuales y ceguera.
El diagnóstico de laboratorio se hace por demostración del gusano adulto en los nódulos extirpados o por demostración de las microfilarias en biopsias de piel.
El reservorio es el ser humano, aunque ocasionalmente se ha observado en gorilas.
La transmisión se da por picaduras de moscas negras hembra del género Simulium, cuyo hábitat preferido son los arroyos y ríos, especialmente los rápidos, donde deposita sus huevos. Son hematófagas y al succionar la sangre de un huésped infectado ingieren las microfilarias de la piel. En el interior de la mosca la larva se vuelve infectante en un plazo de 6 a 8 días y será inoculada en otra picadura de la mosca para alimentarse. Es rara la infección en viajeros y se precisan normalmente meses de estancia en áreas endémicas para que se produzcan picaduras infectantes (ya que las moscas negras no son vectores especialmente eficaces en la transmisión).
Un informe reciente de la Red de Vigilancia GeoSentinel destaca que, entre 1995 y 2004, la mayoría (95%) de los viajeros que adquirieron oncocercosis lo hizo en el África subsahariana y sólo 3 infecciones fueron adquiridas en otros lugares. Como era de esperar, la mayoría de los casos (62%) se observaron en inmigrantes y/o refugiados.

El periodo de transmisibilidad, entendido como el periodo en el que una persona infectada es infectante para las moscas, es de 10 a 15 años, mientras existan microfilarias vivas en piel.
La susceptibilidad es probablemente universal, pudiendo producirse reinfecciones que agravan el cuadro.
SITUACIÓN MUNDIAL
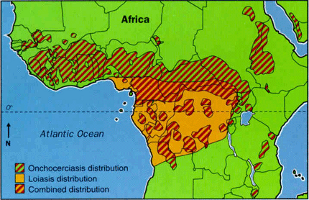
La oncocercosis esendémica en 34 países: la mayoría de los países son los situados en una banda ancha de la parte central de África, pero también está presente en pequeños focos endémicos en la Península Arábiga (Yemen) y en 13 focos aislados en América Latina (en Brasil, Colombia, Ecuador, Guatemala, el sur de México y Venezuela).
Se estima que aproximadamente hay 90 millones de personas en riesgo -de ellas, solo unas 470.000 viven en América- y 17millones depersonas infectadasen todo el mundo.La mayoría de los casos (90%) sintomáticos ocurren en ÁfricaSubsahariana, sobre todo en Nigeria y R.Dem. del Congo. De los afectados, se estima que unos 270.000 presentan ceguera y otros 500.000 presentan alguna lesión visual.
Cabe destacar el “Programa de lucha contra la oncocercosis en África Occidental” creado por la OMS, el PNUD, la FAO y el Banco Mundial en 1974. Este programa abarcaba 11 países donde la oncocercosis era endémica (Benin, Burkina Faso, Costa de Marfil, Ghana, Níger, Mali, Togo, y después Guinea, Guinea-Bissau, Senegal y Sierra Leona). El control consistió durante años en combatir los simúlidos con insecticidas rociados desde helicópteros en los criaderos ubicados en los ríos, pero desde 1987 se ha distribuido además Ivermectina a gran escala, a dosis repetidas. El programa se cerró en 2002, habiendo conseguido la interrupción de la transmisión en todos los países participantes salvo en S.Leona, que interrumpió las operaciones debido a la guerra civil.
En 1995 se creó un nuevo programa para incluir países que no participaban previamente. Actúa sobre 19 países, basándose fundamentalmente en la administración de Ivermectina. En 2002 se habían tratado bajo la cobertura de este programa más de 27 millones de personas en 16 países, habiéndose prevenido aproximadamente 43.000 casos de ceguera anuales. Se pretende una cobertura terapéutica del 65% en los países del programa (aún no conseguida en muchos de ellos), meta de cobertura para lograr la eliminación de la enfermedad.
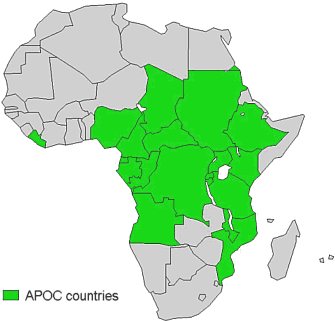
Países con Oncocercosis en África (Fuente: OMS)
El “Programa de eliminación de la oncocercosis en el continente americano” (establecido en 1992) intenta eliminar la enfermedad de los 6 países aún afectados y se plantea el objetivo de la eliminación definitiva en esta región para el año 2015. Se basa también en la administración de Ivermectina en masa cada 6 meses. En 2002 se alcanzaba una cobertura del 85%, salvo en Venezuela, donde sólo llegó a alcanzar el 65%. A finales de 2007, los seis países endémicos habían ya establecido programas nacionales eficaces en los 13 focos de enfermedad conocidos con una cobertura de tratamiento de al menos el 85% de la población dos veces al año. Desde entonces no hay nuevos casos de ceguera atribuible a la oncocercosis en esta región de América y las lesiones oculares atribuibles a la oncocercosis han sido eliminadas en 9 focos.
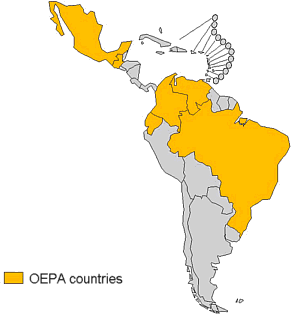
Países con Oncocercosis en América (Fuente: OMS)
LOASIS
EPIDEMIOLOGÍA
La Loasis es una enfermedad crónica causada por otra especie de filaria, la Loa loa, que migra por los tejidos subcutáneos o más profundos del cuerpo causando el denominado “edema de Calabar”, que son inflamaciones transitorias de varios cms de diámetro en cualquier parte del cuerpo, pero que afecta típicamente a la parte distal de las extremidades y al tejido periorbitario. La hinchazón es dolorosa, pero se resuelve en 1-2 días. Un fenómeno espectacular es ver la migración del gusano adulto, de varios cms, a través de la esclerótica ocular.
En quienes no residen en zonas endémicas aparecen fiebre, urticaria y eosinofília intensa asociadas, que suelen ser mucho menos exageradas en la población autóctona.
Las microfilarias se encuentran en sangre periférica con periodicidad diurna y el diagnóstico se hace por demostración de las mismas en frotis de sangre periférica o por demostración del adulto en biopsia de piel.
El reservorio es exclusivamente humano, y la transmisión se produce por picadura de un vector transmisor, las moscas del género Chrypsos, fundamentalmente las especies C. silaceus y C. dimidiatus. La infección en viajeros es rara, siendo los viajeros de mayor riesgo los que permanecen en zonas de transmisión durante largos períodos de tiempo aunque han sido documentados algunos casos en personas que estuvieron en zonas de riesgo menos de un mes.

El periodo de incubación puede ser de pocos meses desde la picadura de la mosca hasta la aparición de los síntomas (las microfilarias son detectables en sangre tras unos 6 meses) pero la clínica normalmente aparece tras varios años.
El periodo de transmisibilidad, entendido como el periodo en el que una persona infectada es infectante para las moscas, es de 10 a 15 años, mientras perdure el gusano adulto y genere microfilarias. En la mosca la larva se hace infectante en unos 10-12 días y permanecerá infectante toda su vida.
La susceptibilidad es universal, pudiendo producirse reinfecciones que agravan el cuadro.
SITUACIÓN MUNDIAL
La enfermedad es endémica en África Central y del Este (de Benin a Sudan y Uganda en dirección este-oeste y desde 10 º de latitud hasta Angola en dirección norte-sur). Se estima una población infectada entre 3 y 13 millones de personas.
Especialmente afectadas están Nigeria y Camerún, sobre todo sus zonas boscosas. En la cuenca del río Congo (República Centroafricana, República del Congo y República Democrática del Congo) hasta el 90 % de la población en algunas aldeas está infectada.